La FDA aprueba la primera píldora fabricada con caca humana
La Administración de Alimentos y Medicamentos de Estados Unidos (FDA) ha aprobado la primera píldora fabricada a partir de caca humana donada, según anunció la agencia el miércoles (26 de abril). Es el segundo tratamiento derivado de la caca humana que se aprueba; el primero fue un tratamiento a base de enema (abre en nueva pestaña) autorizado para su uso en diciembre de 2022.
Anteriormente, estos "trasplantes de microbiota fecal" se consideraban tratamientos en investigación y, por tanto, eran de más difícil acceso para los pacientes y a menudo no estaban cubiertos por los seguros.
Al igual que el tratamiento por enema aprobado, la píldora recién aprobada, denominada Vowst, también contiene bacterias vivas y ha sido aprobada para su uso en personas mayores de 18 años como tratamiento preventivo de las infecciones recurrentes por la bacteria Clostridioides difficile. Esta infección, denominada abreviadamente C. difficile, se adquiere a menudo en entornos sanitarios después de que los pacientes hayan tomado antibióticos para otra infección.
La FDA ha aprobado un tratamiento de primera clase hecho con caca humana. ¿Para qué sirve?
La FDA aprueba la primera vacuna contra el VRS
Los antibióticos pueden alterar el equilibrio de las bacterias que normalmente pueblan el intestino, y esto da a C. diff la oportunidad de proliferar. Las bacterias, que se replican rápidamente, segregan toxinas que pueden provocar diarrea, dolor abdominal, fiebre y colitis (inflamación del colon) y, en algunos casos, insuficiencia orgánica y muerte. Las infecciones por C. difficile se asocian a entre 15.000 y 30.000 muertes al año en EE.UU., según la FDA.
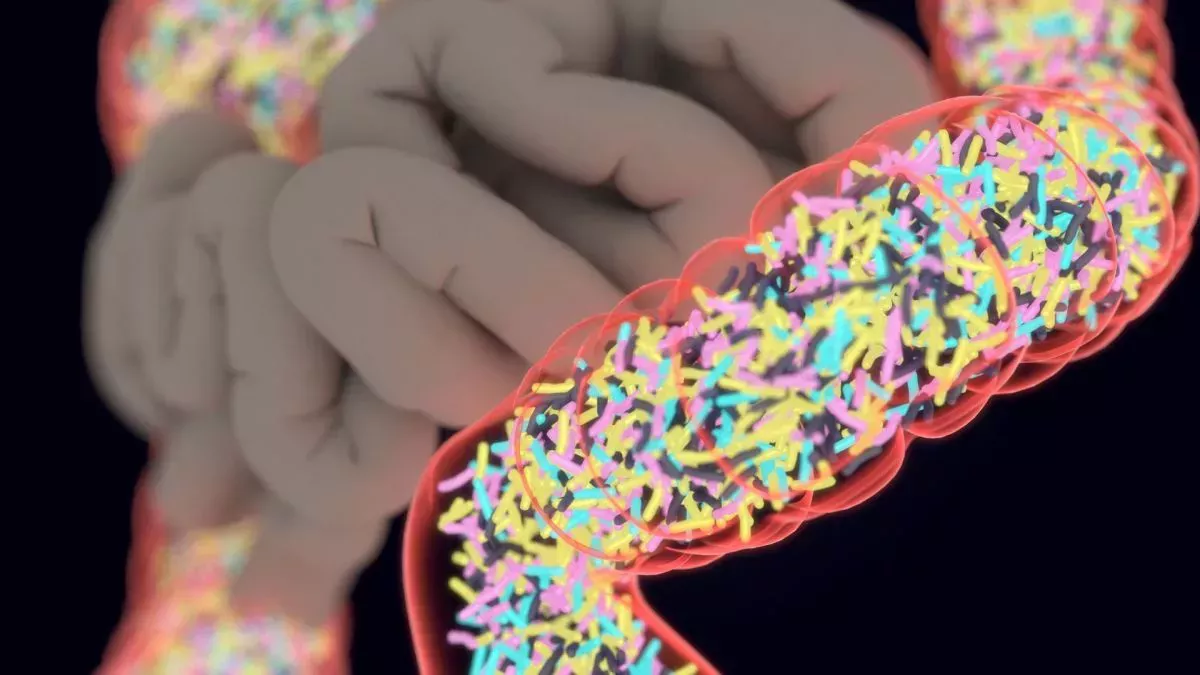
¿Qué es un trasplante fecal?
Según los Centros para el Control y la Prevención de Enfermedades (Centers for Disease Control and Prevention), las personas que se recuperan de una infección por C. difficile tienen una probabilidad aproximada de 1 entre 6 de volver a contraer la infección en las dos a ocho semanas siguientes a su recuperación (se abre en una nueva pestaña). El riesgo de estas infecciones recurrentes aumenta cada vez que una persona contrae C . difficile, en parte porque los antibióticos utilizados para tratarlas alteran aún más el microbioma intestinal, la comunidad de microorganismos del tracto digestivo inferior.
Los denominados productos de microbiota fecal, elaborados a partir de bacterias intestinales humanas sanas, ofrecen una nueva forma de prevenir la C. difficile recurrente, esencialmente reponiendo el microbioma intestinal. Y ahora, con la aprobación de Vowst, existe una versión del tratamiento que puede tomarse por vía oral, en lugar de administrarse como tratamiento líquido en el recto del paciente.
"La disponibilidad de un producto de microbiota fecal que puede tomarse por vía oral es un importante paso adelante en el avance de la atención al paciente y la accesibilidad para las personas que han padecido esta enfermedad que puede ser potencialmente mortal", afirmó en el comunicado de la agencia el Dr. Peter Marks (se abre en una nueva pestaña), director del Centro de Evaluación e Investigación Biológica de la FDA.
El régimen de tratamiento con Vowst consiste en tomar cuatro cápsulas al día durante tres días seguidos; los pacientes empiezan a tomar el medicamento entre dos y cuatro días después de terminar un tratamiento con antibióticos para la C. difficile. Las heces donadas que se utilizan para fabricar las píldoras se analizan cuidadosamente para detectar patógenos transmisibles antes de su uso en la fabricación, pero tomar Vowst sigue conllevando cierto riesgo de exposición a patógenos, así como a alérgenos alimentarios, advirtió la FDA.
En los ensayos clínicos, los efectos secundarios más frecuentes de Vowst fueron hinchazón abdominal, fatiga, estreñimiento, escalofríos y diarrea; estos efectos secundarios se produjeron con mayor frecuencia en los pacientes tratados que en los que recibieron placebo.
En una comparación de unas 90 personas que recibieron las pastillas y 90 que no las recibieron, las del grupo tratado presentaron una tasa del 12,4% de recurrencia de la infección por C. difficile en las ocho semanas siguientes a la recuperación de un brote inicial de la infección, mientras que las del grupo no tratado presentaron una tasa del 39,8% de recurrencia.




