La FDA advierte de que no se deben utilizar colirios de "líquido amniótico
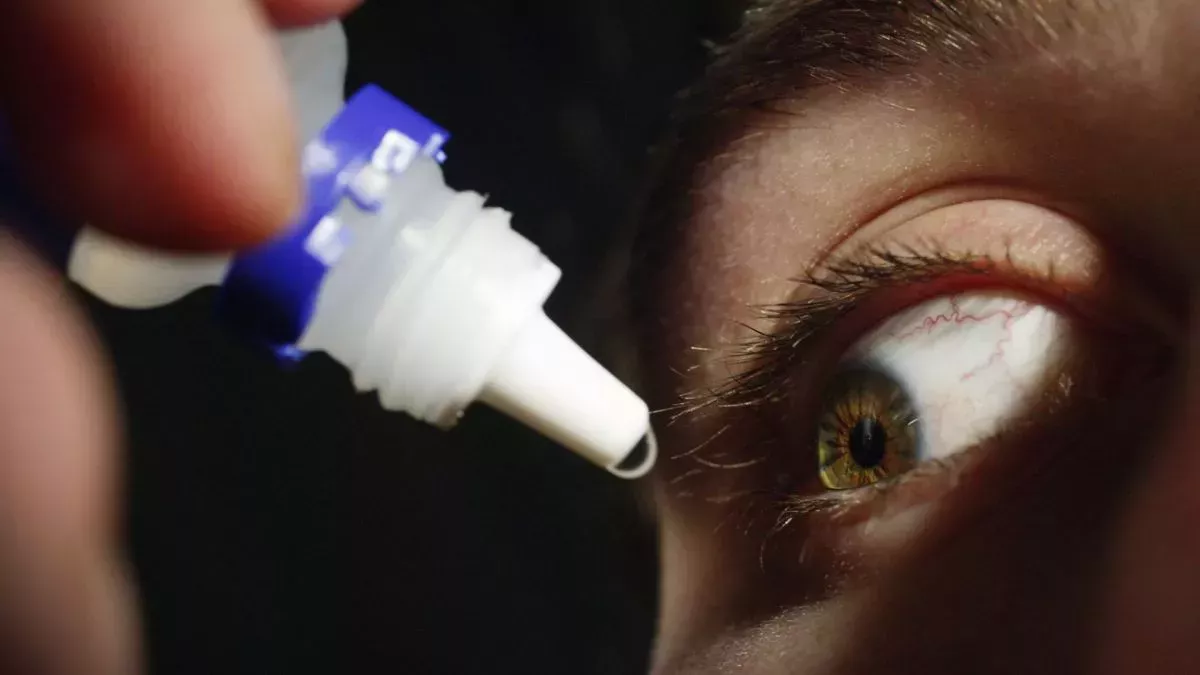
La Administración de Alimentos y Medicamentos (FDA) ha advertido que no se deben utilizar gotas oftálmicas comercializadas como si contuvieran líquido amniótico, el líquido que rodea y amortigua al feto en desarrollo en el útero. La venta de estas gotas oftálmicas, ninguna de las cuales ha sido aprobada por la FDA, plantea "importantes problemas potenciales de seguridad", escribió la agencia en un comunicado (se abre en una nueva pestaña) publicado el 10 de abril.
Dado que la FDA no ha aprobado ningún colirio de este tipo, habría que prescribirlo en el marco de una solicitud de nuevo fármaco en investigación (IND). Además, el paciente tendría que firmar un formulario de consentimiento reconociendo que el producto se utilizaba en el marco de una solicitud IND. Sin embargo, la notificación de seguridad pública de la FDA se debió a que los productos se vendían directamente a los consumidores por Internet, según el comunicado de la agencia.
"Como estos productos no están aprobados por la FDA, la agencia no dispone de información sobre su fabricación, y no hay garantías de que los productos sean seguros y eficaces para ninguna enfermedad o afección", reza el aviso de la FDA.
Cuidado con los imitadores de Ozempic que contienen principios activos no autorizados, advierte la FDA
La FDA advierte a los fabricantes de alimentos para bebés de que "deben tener en cuenta los riesgos químicos" de los alimentos que venden
A finales de 2022, antes de enviar su reciente aviso de seguridad, la agencia reguladora de medicamentos envió dos cartas de advertencia a "fabricantes que comercializan colirios de líquido amniótico": una a Regener-Eyes (se abre en una nueva pestaña), que fabrica un colirio del mismo nombre, y a M2 Biologics (se abre en una nueva pestaña), que fabrica un producto llamado StimulEyes. Ambos productos se comercializaban como tratamientos para la enfermedad del ojo seco.
Gotas oftálmicas retiradas después de que los CDC las relacionaran con pérdida de visión y 1 muerte
Las cartas de la FDA no mencionan específicamente el líquido amniótico en su texto principal, pero sí señalan que Regener-Eyes se comercializaba por contener "biomateriales derivados de la placenta" y que StimulEyes figuraba como "medicamento regenerativo". Regener-Eyes también tenía anteriormente una página web (se abre en una nueva pestaña) en la que se presentaban estudios sobre el líquido amniótico y "terapias derivadas del amniótico", según informó Ars Technica (se abre en una nueva pestaña) el 20 de abril.
(Según el aviso de seguridad y las cartas de la FDA, así como los sitios web de las empresas, no está claro si alguno de los fabricantes ha hecho alguna afirmación sobre la procedencia del líquido amniótico. Además, la FDA no indica si ha realizado pruebas para comprobar si las gotas contienen realmente líquido amniótico).
Si las gotas oculares contuvieran realmente líquido amniótico, es probable que contuvieran "cientos de proteínas fetales diferentes y otras sustancias, que no [necesariamente] sólo hacen cosas útiles, por lo que existen riesgos indudables", declaró a MedPage Today Paul Knoepfler (se abre en una nueva pestaña), profesor de biología celular y anatomía humana de la Universidad de California en Davis (se abre en una nueva pestaña). También podría haber riesgo de infección más allá del ojo, si los productos llegaran al torrente sanguíneo, añadió.
Al principio del embarazo, el líquido amniótico contiene una mezcla de fluidos y proteínas producidos por el tejido fetal y el cuerpo de la embarazada. Al final del embarazo, el líquido contiene sobre todo orina fetal y "secreciones pulmonares", según el recurso médico StatPearls (se abre en una nueva pestaña).
Entonces, ¿por qué poner líquido amniótico en gotas para los ojos? El líquido amniótico y la membrana amniótica, la capa más interna de la placenta, contienen células madre, por lo que algunos investigadores han propuesto (se abre en una nueva pestaña) que el líquido y el tejido podrían tener propiedades regenerativas útiles en diversas aplicaciones médicas, entre ellas como tratamiento de ciertas afecciones oculares, informa Ars Technica. Sin embargo, sólo se ha probado un colirio de líquido amniótico en un ensayo clínico. En él, los científicos comprobaron si las gotas podían ayudar a acelerar la recuperación de los pacientes tras un tipo de cirugía ocular con láser, pero el producto resultó ineficaz.
En su reciente comunicado, la FDA pedía a los consumidores y a los profesionales sanitarios que notificaran cualquier efecto secundario negativo o reacción relacionada con el uso de gotas oftálmicas de líquido amniótico al programa de notificación de reacciones adversas MedWatch (se abre en una nueva pestaña).




